BJN#246 – Woop Woop, Assassin de l’APOL1 : i’Inaxaplin dans les glomérulopathies liées aux mutations d’APOL1
Merci à Mickaël Bobot, Néphrologue à Marseille et membre du conseil scientifique pour ce résumé.
N’hésitez pas, si vous le souhaitez, à nous envoyer vos lectures !
Cette BJN est rédigée en rapport avec cet article :
Inaxaplin for Proteinuric Kidney Disease in Persons with Two APOL1 Variants, écrit par Egbuna et al., et publié dans le NEJM en Mars 2023.
Introduction
Fréquente en Afrique de l’Ouest, la mutation du gène codant l’alipoprotéine L1 (APOL1) induit une protection contre la maladie du sommeil (trypanosomiase). Il existe deux variants à risque d’APOL1 : G1, et G2, qui entraînent un gain de fonction du canal APOL1. Les patients porteurs de la mutation sont plus à risque de développer une néphropathie glomérulaire de dégradation rapide à type de hyalinose segmentaire et focale, en particulier après un trigger inflammatoire ou viral (VIH, COVID…). Il n’existe pas à l’heure actuel de traitement spécifique de la néphropathie liées aux variants APOL1.
Les atteintes rénales liées aux mutations à risque d’APOL1 seraient médiée par le fait que ces mutations induiraient une augmentation nette de l’efflux de potassium intracellulaire (Olabisi OA et al. PNAS 2016), une déplétion en potassium intracellulaire qui conduirait à une augmentation du stress cellulaire.
L’objectif de cette étude est d’étudier l’effet de l’inaxaplin, un inhibiteur sélectif du canal APOL1, sur la protéinurie.
Patients et méthodes
Partie pré-clinique
- Culture cellulaire :
Etude du flux de thallium (en substitut du flux de potassium) dans des cellules embryonnaires rénales humaines exprimant la séquence de référence APOL1 (GO) et les deux variants pathogènes G1 et G2, sous le contrôle du promoteur inductible par la tétracycline - Expérimentation animale :
Etude de la protéinurie après administration d’inaxaplin ou d’une solution saline contrôle chez des souris transgéniques mutées APOL1 G2 homozygotes avant injection d’interféron gamma (trigger inflammatoire)
Partie clinique :
- Essai de phase 2A en ouvert chez 16 patients avec 2 variants d’APOL1, une HSF documentée à la biopsie rénale, une protéinurie entre 0,7 et 10 g/g de créatininurie, un DFGe > 27 mL/min/1.73m².
- Inaxaplin administrée par voie orale quotidiennement à 15 mg /j pendant 2 semaines puis 15 mg /j pendant 11 semaines.
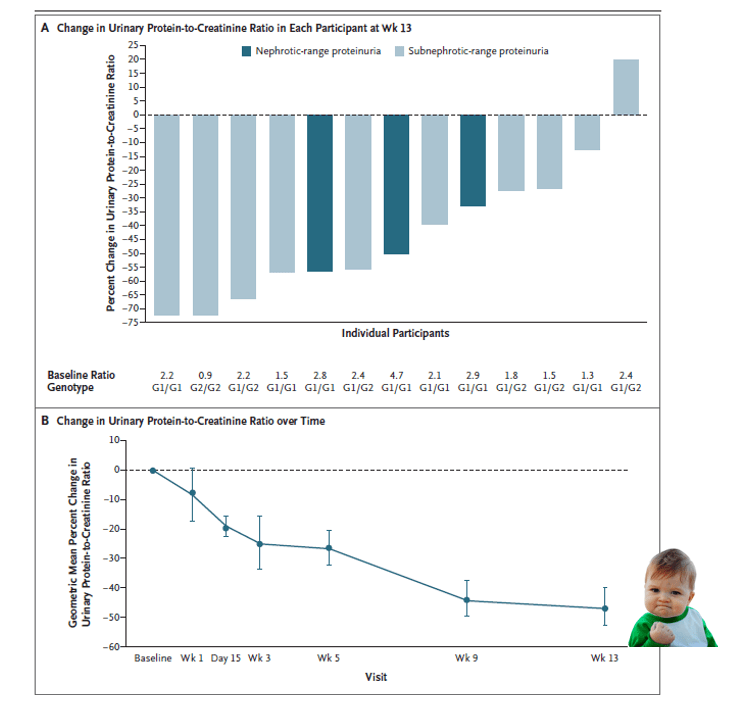
- Critère de jugement principal: variation relative du ratio protéine/créatinine par rapport à la valeur initiale à 13 semaines
- Adhérence au traitement supérieure à 80% requise
- Etude de sureté 28 jours après la dernière administration d’Inaxaplin
Résultats
Partie pré-clinique
- Il existe une augmentation du flux de Thallium dans les cellules exprimant APOL1 G1, par rapport aux cellules exprimant APOL1 G0 (séquence référence).
- L’inaxaplin parvient à inhiber l’efflux de thallium dans les cellules exprimant APOL1 G0, G1 et G2.
- L’inaxaplin se fixait directement sur le canal APOL1
- Chez les souris APOL1 G2 mutées ayant reçu de l’interféron, l’administration d’Inaxaplin réduisait la protéinurie de 72,6% par rapport à l’administration de solution contrôle.
Partie clinique :
- 13 participants traités par inaxaplin avec adhérence au traitement > 80%, diminution moyenne du ratio protéinurie/créatininurie à S14 de −47.6%, IC95% [−60.0 à −31.3].
- Effet similaire en intention de traiter chez les 16 patients.
- Réduction de la protéinurie chez tous les malades sauf un, y compris chez les patients néphrotiques.
- Effets indésirables fréquents mais légers à modérés : nausées, céphalées, douleurs dorsales. Pas d’effet indésirable grave, ni faisant arrêter le traitement.
Conclusion :
L’inhibition de la fonction du canal APOL1 par l’inaxaplin permet de réduire la protéinurie chez les patients avec une HSF et deux variants APOL1.
Les plus du papier
- Association de données pré-cliniques + essai de phase 2
- Essai de phase 2 convaincant pour une molécule novatrice dans une pathologie sans traitement spécifique disponible jusqu’alors
- Avantage de l’administration par voie orale
- Effet antiprotéinurique semblant également exister chez les patients néphrotiques
Les critiques
- Très faible nombre de malades, notamment peu de patients néphrotiques
- Absence de groupe contrôle (limite inhérente à un essai de phase 2)