BJN#81 – Crise de goutte ou crise cardiaque ?
Cardiovascular safety of Febuxostat or Allopurinol in patients with gout
Merci à Julie Morinière Beaume, Néphrologue à Toulon et membre du conseil scientifique du CJN, pour cette synthèse bibliographique. Vous aussi, n’hésitez pas à nous envoyer vos lectures !
Introduction
La maladie goutteuse confère intrinsèquement un risque cardiovasculaire plus élevé. Le Febuxostat est un inhibiteur sélectif non purinique de la xanthine oxydase avec un effet plus puissant que l’allopurinol à doses usuelles dans la réduction de l’hyperuricémie. Les premières études contre placebo et contre allopurinol ont suggéré un modeste sur risque cardiovasculaire sous Febuxostat. L’essai CARES est une étude de sécurité cardiovasculaire visant à montrer la non infériorité du Febuxostat par rapport à l’allopurinol en terme d’évènements cardiovasculaires majeurs chez des patients à haut risque présentant une maladie goutteuse.
Patients/matériels et méthodes
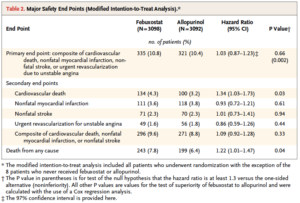
Il s’agit d’une étude randomisée contrôlée en double aveugle chez des patients éligibles en raison d’une maladie goutteuse avec hyperuricémie et un antécédent cardiovasculaire majeur parmi infarctus, angor instable, AVC/AIT, artérite des membres inférieurs ou diabète compliqué de macro/micoangiopathie. Les patients ont été randomisés pour recevoir Febuxostat ou Allopurinol et stratifié selon la fonction rénale (eDFG >60 ou entre 30 et 60ml/min/1,73m2). Le critère d’évaluation principal composite est la première survenue d’un événement cardiovasculaire fatal ou non (infarctus, AVC ou angor instable). Les critères d’évaluation secondaire incluaient de manière individuelle les évènements du critère principal. Les autres critères évalués sont le décès toute cause, la survenue d’un AIT, une hospitalisation pour insuffisance cardiaque, événement thromboembolique ou arythmie.
Résultats
Caractéristiques : 6190 patients ont été inclus pour l’analyse en intention de traiter avec deux groupes comparables en termes de caractéristiques démographiques, cliniques et biologiques. 56% des patients ont interrompu le traitement prématurément de manière similaire dans chaque groupe (taux d’exposition médian au traitement respectivement de 728 et 719 jours, durée médiane de suivi respectivement de 968 et 942 jours dans le groupe Febuxostat versus Allopurinol).
Effets biochimiques : l’uricémie est moins élevée sous Febuxostat par rapport à l’Allopurinol. Le taux de rechute de crise de goutte est similaire entre les 2 groupes.
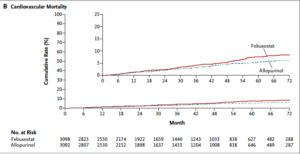
Sécurité cardiovasculaire : 656 évènements sont survenus. Le taux de survenue est similaire entre les deux groupes Febuxostat et Allopurinol à une période médiane de 32 mois (10,8 et 10,4% respectivement p=0,002 pour la non infériorité). Le risque de décès toute cause et de décès cardiovasculaire est néanmoins plus important dans le groupe Febuxostat (respectivement 7,8 versus 6,4% (p=0,04) et 4,3 versus 3,2% (p=0,03)). L’augmentation de mortalité toute cause est liée à une augmentation de la mortalité cardiovasculaire essentiellement par mort subite. Il n’y a pas d’autres différences entre les deux groupes (table 2 et figure 1). Les analyses en sous groupe n’ont pas permis de dégager de facteurs prédictifs significatifs. Les résultats sont retrouvés de manière similaire en intention de traiter et en per traitement.
Conclusion
Le risque de décès cardiovasculaire est supérieur sous Febuxostat versus Allopurinol chez une population à haut risque cardiovasculaire. Le mécanisme de ce sur risque n’est pas clair puisque les études préliminaires n’ont pas montré de toxicité cardiaque intrinsèque du Febuxostat et que le taux d’évènements cardiovasculaires non fatals n’est pas différent entre les 2 groupes. Une des limitations principales est le nombre important de patients ayant interrompu l’étude. Les auteurs ne concluent pas sur la prudence de prescription du Febuxostat chez les patients à haut risque cardiovasculaire mais la FDA américaine a émis une alerte de sécurité dans l’attente d’analyses plus complètes.

