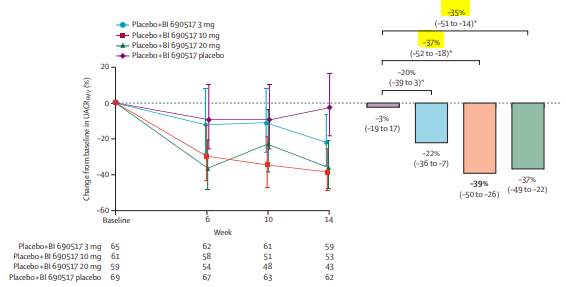
BJN#254_Du nouveau dans les anti-aldostérones: Blocage de l’aldostérone plutôt que du récepteur aux minérallocorticoïdes c’est possible ?
Merci à Céline CARREIRA, de Soissons, membre du conseil scientifique pour ce résumé. N’hésitez pas, si vous le souhaitez, à nous envoyer vos lectures ! Cette BJN est rédigée en rapport avec cet article : Efficacy and safety of aldosterone synthase inhibition with and without empagliflozin for chronic kidney disease: a randomised, controlled, phase 2 trial, de Katherine R Tuttle et al. et publiée dans le Lancet en janvier 2024 Introduction : L’aldostérone accélère la progression de la maladie rénale chronique notamment via l’inflammation et la [...]