Hyperoxalurie primitive de type 1
- La plus fréquente des HOP, même si cela reste une maladie rare (1/120 000 naissances)
- Transmission Autosomique Récessive
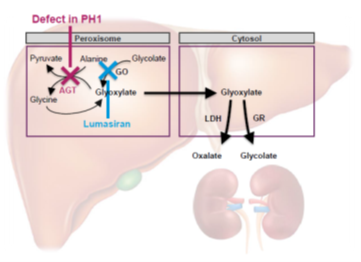
- Enzyme déficiente : Alanine Glyoxylate Aminotransferase ou AGT, dont l’expression est uniquement hépatique, dans les peroxysomes
- Co-facteur enzymatique : Phosphate de pyridoxine (Vitamine B6)
- L’AGT métabolise le glyoxylate dans les peroxysomes en Glycine et Pyruvate. Lorsqu’elle fait défaut, le glyoxylate est métabolisé par la LDH en oxalate.
- Anomalies génétiques sur le chromosome 2. Plus de 170 mutations décrites, ponctuelle dans 75% des cas.
- Conséquences fonctionnelles : Absence de la protéine (40%), présence d’une protéine inactive (15%), présence d’une protéine fonctionnelle mais erreur d’adressage (mitochondrie vs peroxysome)
- Diversité des phénotypes dans une même famille
- Corrélations phénotype/clinique variable
Conséquences rénales
5 grands phénotypes rénaux :
- Forme infantile, début avant 1 an, avec évolution très rapide vers l’IRT (25%)
- Lithiases répétées et IR précoce (30%)
- Forme tardives avec premières lithiases à l’âge adulte (30%)
- Récidive après transplantation, avec maladie méconnue en pré-greffe (10%)
- Dépistage familial autour d’un cas
- Maladie grave : premiers symptômes à 4 ans, âge au diagnostic 7.7 ans Survie patients : 74% à 50 ans Survie rénale : 10% à 50 ans
Harambat, KI 2010
Atteintes extra rénales
Surtout quand DFG < 30-40 ml/min/1.73m2: atteinte systémique +++
- Osseuses : Densification osseuse supra-métaphysaire des os longs (RX), douleurs, fractures, résistance à l’EPO…
- Articulaires : Synovite, chondrocalcinose
- Oculaires : Dépôts rétiniens et maculaires, Risque de cécité
- Myocardiques : Cardiopathie ischémique, BAV, Arythmie (mort subite)
- Vasculaires : Ulcères, Problèmes de voie d’abord pour HD
- Peau : Acrocyanose, Livedo reticularis
- Nerfs périphériques : Polyradiculonevrites (vasa nervorum)
- Hypothyroïdie
- Atteintes dentaires : douleurs, lyses racinaires
En fait, tant que le rein fonctionne, les conséquences ne sont que rénales. Mais quand le rein ne fonctionne plus, l’oxalate va s’accumuler partout avec des conséquences gravissimes.
Démarche diagnostique
- Suspicion clinique
- Association lithiases radio-opaques, multiples, bilatérales, oxalo-calciques monohydratées, débutant souvent assez jeune, nephrocalcinose, IRC, Atteinte osseuse
- Dans un contexte familial “évocateur” (consanguinité, dialysés…)
- Analyses biologiques
- Analyse des calculs
- Morphologie : Type Ic pathognomonique
- Spectrométrie infrarouge : Oxalate de Ca monohydraté ou Whewhellite
- Cristallurie typique : cristaux de whew nombreux (200 cristaux/mm3 pathognomonique)
- Marqueurs biochimiques :
Hyperoxalurie > 0,5mmol/1,73m2/j, parfois beaucoup plus élevée, parfois moins élevée en cas d’insuffisance rénale.
Dans ce cas, utiliser l’oxalémie mais dosage délicat, et interprétation difficile car augmente en cas d’IR de toute cause. Normale < 7µM.
Si recueil urinaire des 24h difficile (pédiatrie) : rapport oxalurie/créatininurie - Etude de l’activité de l’AGT dans la biopsie hépatique (peu utilisée en pratique)
- Biologie moléculaire : recherche de mutation du gène de l’AGT
- Recherche d’abord d’HOP type I (80%), si négative, recherche type II ou III
- Screening des mutations les plus fréquentes : sensibilité 50-70%
- Puis séquençage complet du gène : sensibilité 98%
- Analyse des calculs
- Possibilité de dépistage prénatal
- Génétique indispensable avant transplantation hépatique
- Valeurs normales d’oxalémie 0,8 – 3,1 µmol / litre
- Valeurs normales d’oxalurie : 70 – 420 µmol / 24h, < 500 µmol / 1,73 m2 /jour
- Rapport oxalate/créatinine en fonction de l’âge :
- < 1 an < 260 µmol / mmol
- 1 – 2 ans < 170 µmol / mmol
- 2 – 5 ans < 100 µmol / mmol
- 5 – 12 ans < 80 µmol / mmol
- > 12 ans < 50 µmol / mmol
- Adultes 26 µmol / mmol
- Rapport glycolate/créat: 25-76 µmol / mmol
Penser à rechercher les atteintes extra-rénales
- Os : Radios, DMO
- Myocarde : ECG, Echo cœur voire Holter ECG
- Vaisseaux : radios, doppler artériel
- Thyroïde : TSH
- Dents : consultation dentiste
- Recherche d’anémie (IRC, oxalose médullaire)
HOP type 1 Traitement
-
- Traitement médical préventif :
- Boissons abondantes sans alcalins, 3 L/1.73 m2/j, bien répartis sur le nycthémère
- Objectif oxalurie <0.4 µmol/l en permanence
- Régime alimentaire pauvre en oxalate (Légumes type épinards, rhubarbe, Chocolat, Thé…) MAIS efficacité limitée car apports alimentaires <20% oxalurie
- Pas de réduction des apports calciques, au contraire ! Maintien de la chélation OxCa dans l’intestin pour diminuer l’absorption de l’oxalate libre
- Eviter la Vitamine C : traque aux supplémentations vitaminiques intempestives !
- Inhibiteurs de la cristallisation :
- Citrate de potassium 100-150mg/kg/j
- Magnésium 500 mg/m2/j
- Supplémentation en Orthophosphate (sauf IRC) 30 à 40 mg/kg, jusqu’à 60 mg/kg en période de croissance
- Diurétiques : avec prudence, surtout chez l’enfant. Thiazidiques, jamais de Furosémide (Hypercalciuriant, précipitation de la création de cristaux d’oxalate de Ca)
- Supplémentation en Vit B6 – pyridoxine : à tester systématiquement car bénéfice net pour les patients sensibles. Sensibilité variable selon les mutations (Gly170Arg). Doses croissantes de 5 à 20mg/Kg/jour. A poursuivre jusqu’à la greffe hépatique si réponse positive (diminution de l’oxalurie de 30%), arrêter sinon.
- Oxalobacter formigenes : Bonne idée, mais études décevantes
- Traitement médical préventif :
-
- Traitement urologique des lithiases :
- Préférer néphrostomie, JJ, urétéroscopie souple
- Eviter LEC (risque de lésion du parenchyme rénal)
- Eviter chirurgie à ciel ouvert
- Epuration ExtraRénale
- L’oxalate a une faible masse moléculaire, donc se dialyse bien
- Mais la surproduction excessive dépasse les capacités d’épuration de toutes les techniques d’EER
- Au maximum épuration de 1 440 µmol/j vs production 3 500 à 7 500 µmol/j, d’où une surcharge tissulaire inexorable
- Séances longues (5h) ET quotidiennes, hémodialyse nocturne
- Membranes hyperperméables et de grande surface
- Convection
- Traitement urologique des lithiases :
-
- Transplantation rein seul?
- Non, car récidive précoce sur le greffon
- Transplantation rein-foie ? Oui, précoce pour limiter les dépôts tissulaires (DFG <25 ml/mn)
- Survie malades : 80% à 5 ans
- Survie Rein : 95% à 3 ans
- Fonction rein: 40 à 60 ml/min à 3 ans
- Facteurs de mauvais pronostic : Age < 5 ans, Dialyse > 2 ans
- Transplantation hépatique préemptive? DFG autour de 45 ml/min
- Améliore l’évolution sur le plan rénal
- Mais lourde morbi-mortalité par rapport au ttt médical! Pour les formes vitamino résistantes+++
- Transplantation foie puis rein ?
- Diminution de l’oxalémie pour protéger le greffon rénal
- Uniquement chez le petit enfant, quand la greffe simultanée n’est pas faisable pour des raisons anatomiques
- Transplantation rein seul?
ATTENTION !! L’Hyperoxalurie peut persister encore pendant 2 ans après la greffe, il faut donc absolument maintenir le traitement médical pour protéger le greffon rénal.
- LUMASIRAN approuvé par la commission européenne (automne 2020) et la FDA
- Thérapie ARN ciblant l’ARNm de l’hydroxyacid oxidase 1 (HAO1), codant pour la glycolate oxidase (GO).
- Diminution de l’ARNm de HAO1
- Diminution de la synthèse de GO
- diminution de la production de Glyoxylate via le Glycolate
- Diminution de la synthèse d’oxalate via la LDH
- diminution de la production de Glyoxylate via le Glycolate
- Diminution de la synthèse de GO
- Diminution de l’ARNm de HAO1
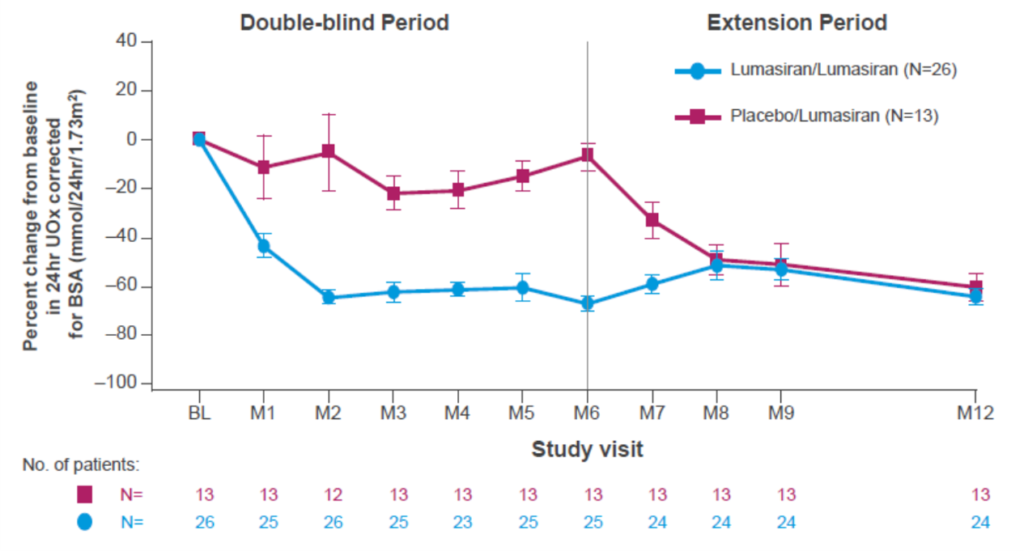
- Etude ILLUMINATE A ClinicalTrials.gov Identifier: NCT03681184
- 39 patients, adultes et enfants ≥ 6 ans
- Oxalurie ≥ 0,7mmol/24h/1,73m2
- Mutation de l’AGT confirmée
- DFG>30mL/min/1,73m2
- Période double aveugle Lumasiran vs Placebo pendant 6 mois
- Lumasiran diminuent l’Ox u des 24h de façon significative (65,4% vs 11,8% avec le placebo)
- Période d’extension de 54 mois
- Les patients traités par Lumasiran/Lumasiran maintiennent la réduction de l’Oxu (moy 64,1% vs baseline)
- Patients traités Placebo/Lumasiran diminuent également l’Oxu, en moyenne 57,3% après 6 mois de traitement
- A 1 an, fonction rénale stable dans les 2 groupes
- Tolérance très correctes (quelques irritations aux points d’injection pour le Lumasiran)
N Engl J Med 2021;384:1216-26.DOI: 10.1056/NEJMoa2021712