BJN#254_Du nouveau dans les anti-aldostérones: Blocage de l’aldostérone plutôt que du récepteur aux minérallocorticoïdes c’est possible ?
Merci à Céline CARREIRA, de Soissons, membre du conseil scientifique pour ce résumé.
N’hésitez pas, si vous le souhaitez, à nous envoyer vos lectures !
Cette BJN est rédigée en rapport avec cet article : Efficacy and safety of aldosterone synthase inhibition with and without empagliflozin for chronic kidney disease: a randomised, controlled, phase 2 trial, de Katherine R Tuttle et al. et publiée dans le Lancet en janvier 2024
Introduction :
L’aldostérone accélère la progression de la maladie rénale chronique notamment via l’inflammation et la fibrose. Les antagonistes des récepteurs aux minéralocorticoides (MRA) ne bloquent pas complètement l’action de l’aldostérone et augmente le risque d’hyperkaliémie. Les inhibiteurs de l’aldostérone synthase bloquent directement l’aldostérone.
Le BI 690517 est un inhibiteur d’aldostérone synthase puissant, sélectif en développement pour le traitement de la MRC.
Il s’agit d’une étude de phase 2, randomisée contre placebo en double aveugle qui étudie l’efficacité et la sécurité de plusieurs doses de BI 690517 seul ou en association avec l’empagliflozine chez des patient présentant une MRC, financée par Boehringer-Ingelheim.
Méthodes :
Etude internationale randomisée contrôlée de phase 2 qui étudie 3 doses de BI 690517 seule ou en association avec l’empaglflozine.
Critères d’inclusion : >18ans, DFGe entre 30 et 90mL/min/1.73m², ratio albuminurie/créatininurie (RAC) entre 200 et 5000mg/g et kaliémie inférieure ou égale à 4.8mmol/L. Inhibiteur du SRAA depuis plus de 4 semaines à dose stable.
Critères d’exclusion : DT1, infection, cancer, IRA < 30 jours, indication à un MRA, traitement par iSGLT2.
Randomisation : 2 phases :
- 1ère randomisation en 1 : 1 pour l’empagliflozine 10mg ou placebo durant 8 semaines (phase de run-in).
- Puis une 2ème randomisation en 1:1 :1 :1 pour le BI 690517 à 3mg, 10 mg ou 20mg ou placebo pendant 14 semaines
Critère de jugement principal : Changement du RAC sur les premières urines du matin après 14 semaines de traitement par rapport à la baseline.
Critères de jugement secondaire : proportion de patient avec une baisse de 15% ou plus, et 30% ou plus du RAC à 14 semaines. Changement du DFGe, kaliémie, pression artérielle, aldostéronémie, cortisolémie.
Les critères de sécurité : effets secondaires, insuffisance hépatique sévère, amputation des membres inférieurs, acidocétose, syndrome de Cushing et insuffisance surrénalienne.
Résultats :
714 patients ont participé à la phase de run in (empagliflozine ou placebo). 586 ont été assigné à recevoir le BI 690517 ou le placebo.
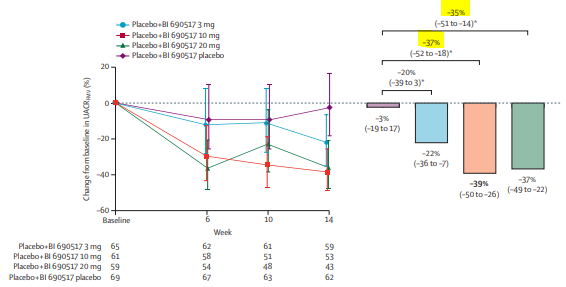
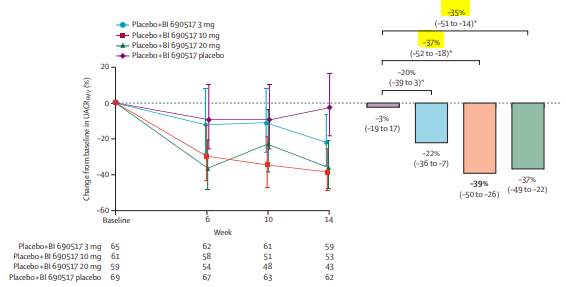
En monothérapie par BI 690517, le RAC variait de -3% (-19 à 17) dans le groupe placebo, -22% (-36 à-7) sous 3mg, -39% (-50 à -26) sous 10mg et -37% (-49 à -22) sous 20mg.
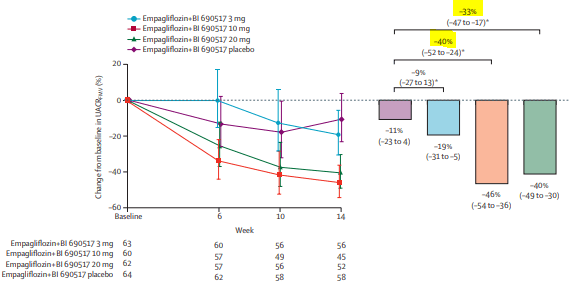
En bithérapie par Empagliflozine + BI 690517, le RAC variait de -11% (-23 à 4) sous placebo du BI 690517, -19% (-31 à -5) sous 3mg, -46% (-54 à -36) sous 10mg et -40 (-49 à -30) sous 20mg.
Pour les critères de jugement secondaire : Dans le groupe BI 690517 10mg, une réduction du RAC de 30% ou plus a été observé chez 51% des patients en monothérapie avec un OR à 6,09 (IC95 2,64-14,08) et chez 70% des patients en bithérapie avec l’empagliflozine (OR 8,42 IC 3,73-19,02).
Sous BI 690517 : Réduction de l’aldostéronémie mais pas la cortisolémie dans tous les groupes. La kaliémie se majorait légèrement (0.2-0.3mmol/L), léger déclin du DFGe.
Pour les critères de sécurité : Absence d’insuffisance hépatique ou d’acido-cétose sévère, pas d’amputation des membres inférieurs. 4 décès sur la période non attribué au traitement. Insuffisance surrénalienne chez 2% des participants sous BI690517 et 1% des participants sous double placebo.
Conclusion :
Réduction du RAC de 37 à 40% sous BI 690517 avec un plateau à la dose de 10mg en monothérapie et également en association avec l’Empagliflozine suggérant un effet additif. Le BI 690517 semble être une molécule intéressante pour réduire le RAC avec un profil de sécurité acceptable.
Les plus du papier :
- Etude randomisée contrôlée, internationale avec un design de qualité
- Nouvelle molécule comparée au standard actuel incluant les inhibiteurs de SGLT2
- Population incluant des patients diabétiques ou non
Critiques :
- Etude de phase 2, donc préliminaire avec une courte durée, pas de critères « dur » (survie, survie rénale, MACE…)
- Pas de comparaison avec les antagonistes du récepteur aux minéralocorticoïdes non stéroïdien +++ qui sont les molécules concurrentes directes.
- Attente de l’étude de phase 3 dont les dates ne sont pas connues.
Mots-clés : IRC, néphroprévention, inhibiteur d’aldosterone synthase, ratio albuminurie sur créatininurie